A. OXI
I. VỊ TRÍ CẤU TẠO
Nguyên tố oxi có số hiệu nguyên tử là 8, thuộc nhóm VIA, chu kì 2 của bảng tuần hoàn các nguyên tố hoá học.
Nguyên tử oxi có cấu hình electron là 1s22s22p4, lớp ngoài cùng có 6e.
Trong điều kiện bình thường, phân tử oxi có 2 nguyên tử liên kết với nhau bằng liên kết cộng hoá trị không cực
Công thức cấu tạo của phân tử oxi là O=O.
II. TÍNH CHẤT VẬT LÝ
Khí oxi không màu, không mùi, không vị, hơi nặng hơn không khí . Dưới áp suất khí quyển, oxi hoá lỏng ở nhiệt độ -183oC. Khi oxi hoá ít trong nước (100ml nước ở 20oC, 1 atm hoà tan được 3,1ml khí oxi. Độ tan của khí oxi ở 20oC và 1 atm là 0,0043 g trong 100g H2O).
III. TÍNH CHẤT HOÁ HỌC
Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Nguyên tử oxi có độ âm điện lớn (3,44), chỉ kém flo (3,98).
Do vậy, oxi là nguyên tố phi kim hoạt động hoá học, có tính oxi hoá mạnh. Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hoá là -2. Oxi tác dụng với hàu hết các kim loại (trừ Au, Pt ...) và các phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
Dưới đây là một số thí dụ:
1. Tác dụng với kim loại
Magie cháy trong khí oxi: 2Mg + O2 → 2MgO
2. Tác dụng với phi kim
Cacbon cháy trong khí oxi: C + O2 → CO2
3. Tác dụng với hợp chất
CO cháy trong không khí: 2CO + O2 → 2CO2
Etanol cháy trong không khí: C2H5OH + 3O2 → 2CO2 + 3H2O
IV. ỨNG DỤNG
Oxi có vai trò quyết định đối với sự sống của người và động vật. Mỗi người mỗi ngày cần từ 20 - 30m3 không khí để thở.
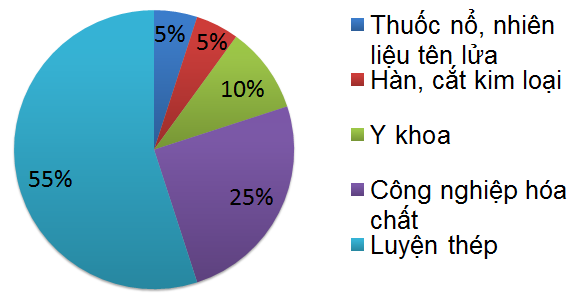
Hằng năm, các nước trên thế giới sản xuất hàng chục triệu tấn oxi để đáp ứng nhu cầu cho các ngành công nghiệp.
V. ĐIỀU CHẾ
1. Điều chế oxi trong phòng thí nghiệm
Trong phòng thí nghiệm, khí oxi được điều chế bằng cách phân huỷ những hợp chất giàu oxi và ít bền đối với nhiệt như KMnO4 (rắn), KClO3 (rắn)...
2KMnO4 →(to) K2MnO4 + MnO2 + O2↑
2KClO3 →(to ; xt: MnO2) 2KCl + 3O2↑
2. Sản xuất oxi trong công nghiệp
a. Từ không khí: Không khí sau khi đã loại bỏ hết hơi nước, bụi, khí cácbon đioxit, được hoá lỏng. Chưng cất phân đoạn không khí lỏng, thu được oxi. Oxi được vận chuyển trong những bình thép có dung tích 100lít dưới áp suất 150 atm.
b. Từ nước: Điện phân nước (nước có hoà tan một ít H2SO4 hoặc NaOH để tăng tính dẫn điện của nước), người ta thu được khí oxi ở cực dương và khí hiđro ở cực âm
2H2O → 2H2 + O2
B. OZON
I. TÍNH CHẤT
Ozon là một dạng thù hình của oxi.
Ozon là chất khí màu xanh nhạt, có mùi đặc trưng.
Hóa lỏng ở -112oC.
Tan nhiều trong nước hơn oxi.
O3 có tính oxi hoá mạnh hơn O2.
II. OZON TRONG TỰ NHIÊN
Ozon được tạo thành trong khí quyển khi có sự phóng điện( tia chớp, sét).
O2 →(tia tử ngoại) O3
Trên mặt đất, ozon được sinh ra do sự oxi hóa một số chất hữu cơ.
III. ỨNG DỤNG
Trong công nghiệp,người ta dùng ozon để tẩy trắng tinh bột, dầu ăn và nhiều vật phẩm khác,…
Trong y học, Ozon được dùng để chữa sâu răng.
Trong đời sống, người ta dùng ozon để sát trùng nước sinh hoạt.

.jpg)
.jpg)




.jpg)
.jpg)










