I- TÍNH CHẤT HÓA HỌC
Ở phân tử ankan chỉ có các liên kết C−C và C−H. Đó là các liên kết σ bền vững, vì thế ankan tương đối trơ về mặt hóa học: Ở nhiệt độ thường chúng không phản ứng với axit, bazơ và chất oxi hóa mạnh (như KMnO4). Vì thế ankan còn có tên là parafin, nghĩa là ít ái lực hóa học.
Dưới tác dụng của ánh sáng, xúc tác và nhiệt, ankan tham gia các phản ứng thế, phản ứng tách và phản ứng oxi hóa.
1. Phản ứng thế
Khi chiếu sáng hoặc đốt nóng hỗn hợp metan và clo sẽ xảy ra phản ứng thế lần lượt các nguyên tử hiđro bằng clo:
CH4+Cl2→CH3Cl+HCl
metyl clorua (clometan)
CH3Cl+Cl2→CH2Cl2+HCl
metylen clorua (điclometan)
CH2Cl2+Cl2→CHCl3+HCl
clorofom (triclometan)
CHCl3+Cl2→CCl4+HCl
cacbon tetraclorua(tetraclometan)
Các đồng đẳng của metan cũng tham gia phản ứng thế tương tự metan. Thí dụ:
CH3−CH2−CH3→(25oC Cl2,as) CH3−CHCl−CH3+CH3−CH2−CH2−Cl+HCl
2−clopropan,57%1−propan,43%
CH3−CH2−CH3→(Br2,as25oC) CH3−CHBr−CH3+CH3−CH2−CH2−Br+HBr
97%(chính)3%(phụ)
Phản ứng thế H bằng halogen thuộc loại phản ứng halogen hóa, sản phẩm hữu cơ có chứa halogen gọi là dẫn xuất halogen.
Clo thế H ở cacbon bậc khác nhau Brom hầu như chỉ thế H ở cacbon bậc cao. Flo phản ứng mãnh liệt nên phân hủy ankan thành C và HF. Iot quá yếu nên không phản ứng với ankan.
Cơ chế phản ứng halogen hóa ankan
Phản ứng clo hóa và brom hóa ankan xảy ra theo cơ chế gốc - dây chuyền.
Bước khơi mào:
![]()
Bước phát triển dây chuyền:
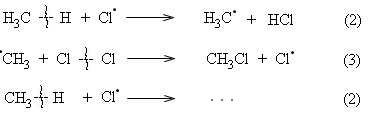
.......
Bước đứt dây chuyền:
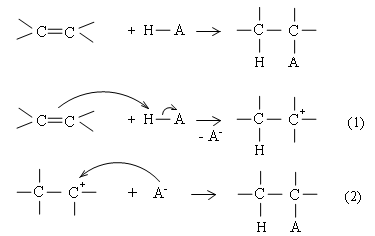
(1): Phân tử clo hấp thụ ánh sáng bị phân cắt đồng li thành 2 nguyên tử clo.
(2): Nguyên tử clo là một gốc tự do hoạt động, nó ngắt lấy nguyên tử H từ CH4 tạo ra HCl và gốc tự do .CH3 .
(3): Gốc .CH3 không bền, nó tách lấy nguyên tử Cl từ Cl2 để trở thành CH3Cl bền hơn. Nguyên tử Cl. mới sinh ra ở phản ứng (3) lại tác dụng với CH4 làm cho phản ứng (2) và (3) lặp đi lặp lại tới hàng chục ngàn lần như một dây chuyền.
(4)(5)(6): Các gốc tự do kết hợp với nhau thành các phân tử bền hơn
2. Phản ứng tách (gãy liên kết C−C và C−H)
Nhận xét: Dưới tác dụng của nhiệt và xúc tác (Cr2O3,Fe,Pt,...) các ankan không những bị tách hiđro tạo thành hiđrocacbon không no mà còn bị gãy các liên kết C−C tạo ra các phân tử nhỏ hơn.
3. Phản ứng oxi hóa
* Khi đốt, các ankan bị cháy tạo ra CO2,H2O và tỏa nhiều nhiệt:
CH4+2O2→CO2+2H2O ; ΔH=−890kJ
CnH2n+2+3n+1 / 2 O2→nCO2+(n+1)H2O
Các ankan đầu dãy đồng đẳng rất dễ cháy, tỏa nhiều nhiệt. Khí CO2, hơi nước và nhiệt tạo ra nhanh nên có thể gây nổ.
Nếu không đủ oxi, ankan bị cháy không hoàn toàn, khi đó ngoài CO2 và H2O còn tạo ra các sản phẩm như CO, muội than, không những làm giảm năng suất tỏa nhiệt mà còn gây độc hại cho môi trường.
Khi có xúc tác, nhiệt độ thích hợp, ankan bị oxi hóa không hoàn toàn tạo thành dẫn xuất chứa oxi, thí dụ:
CH4+O2→to,xt HCH=O+H2O
II - ĐIỀU CHẾ VÀ ỨNG DỤNG
1. Điều chế
a) Trong công nghiệp
Metan và các đồng đẳng được tách từ khí thiên nhiên và dầu mỏ (xem bài Dầu mỏ).
b) Trong phòng thí nghiệm
Khi cần một lượng nhỏ metan, người ta nung natri axetat với vôi tôi xút, hoặc có thể cho nhôm cacbua tác dụng với nước:
CH3COONa(r)+NaOH(r)→−−nung(CaO) CH4↑+4Al(OH)3
Al4C3+12H2O→3CH4↑+4Al(OH)3
2. Ứng dụng
Làm nhiên liệu, vật liệu ← ANKAN → Làm nguyên liệu.

.jpg)
.jpg)




.jpg)
.jpg)










