Sự khác nhau về cấu tạo và khả năng phản ứng của hidrocacbon no và không no đã rõ ràng. Những hidrocacbon với liên kết đơn không có khả năng phản ứng với đại bộ phận tác nhân ngoại trừ phản ứng thế hidro bằng halogen trong điều kiện nghiêm ngặt. Trong khi đó các anken và ankin phản ứng với axit, với chất oxi hóa, kết hợp với halogen và các tác nhân khác. Hidrocacbon thơm (loại thứ ba) không thể xếp vào loại hợp chất chứa liên kết đôi và ba. Tên gọi "thơm" xuất phát từ chỗ những hợp chất đầu tiên tìm được thuộc loại đó có mùi thơm khác nhau. Tên thơm vẫn giữ cho đến ngày nay, mặc dầu hóa học của hidrocacbon thơm bao gồm cả những hợp chất không có mùi thơm. Chúng thể hiện tính chất thơm tương tự benzen. Hidrocacbon thơm là loại hidrocacbon mạch vòng có tính chất thơm mà benzen là điển hình và quan trọng nhất.
1. Cấu trúc và tính thơm
a. Cấu trúc của benzen
Benzen có công thức phân tử C6H6. Năm 1825 lần đầu tiên FaradayM. phát hiện benzen trong khí đốt. Năm 1834 Mitscherlich E.A điều chế benzen từ acid benzoic thu được từ cây Styrax benzoin. Năm 1845, Hofmann tìm thấy benzen trong nhựa than đá. Benzen có một số tính chất đặc trưng gọi là "tính thơm". Để giải thích tính chất đặc trưng đó các nhà hóa học đã đưa ra các dạng công thức cấu tạo của benzen.
Bằng các phương pháp vật hiện đại: phương pháp Ronghen, quang phổ và nhiễu xạ điện tử, cấu tạo của benzen đã được xác định như sau:
- Benzen có cấu tạo vòng phẳng, 6 nguyên tử carbon và 6 nguyên tử hydro đều nằm trong một mặt phẳng. Vòng benzen hoàn toàn đối xứng.
- Khoảng cách giữa các nguyên tử carbon trong vòng đều bằng nhau 1,398 Angtron là đại lượng trung gian giữa độ dài liên kết đơn thuần túy và 1,54 và liên kết đôi 1,35Angtron. Góc giữa các liên kết C-C-C và C-C-H đều bằng nhau và có giá trị 120o
- Mỗi nguyên tử carbon tạo 3 liên kết xích - ma. Trong đó có 2 liên kết xích - ma do sự xen phủ của 2 orbital lai hóa sp2 giữa carbon - carbon bên cạnh nhau. Còn một liên kết xích - ma giữa C-H do xen phủ của orbital lai hóa sp2 của carbon và của orbital s của hydro
+ Trên mỗi nguyên tử carbon còn một orbital p chưa lai hóa
+ Trục các orbital này thẳng góc với mặt phẳng của vòng benzen
Tất cả các orbital này xen phủ lẫn nhau tạo thành một orbital phân tử pi chung duy nhất. Như vậy các orbital p trong vòng benzen đã liên hợp với nhau thành một hệ thống liên hợp hoàn chỉnh. Do hệ thống liên hợp này mà khoảng cách giữa các nguyên tử carbon trong vòng benzen hoàn toàn đồng nhất.
Benzen trở nên bền vững, khó tham gia phản ứng cộng hợp, khó bị oxy hóa và dễ tham gia phản ứng thế. Tính chất đặc trưng này của benzen gọi là "tính thơm"

Vậy, tính thơm là tính chất của những hệ vòng chưa no, bền vững, khi mở vòng năng lượng của hệ tăng lên. Hệ này dễ tham gia phản ứng thế, khó tham gia phản ứng cộng và khó bị oxi hóa. Các nhóm thế có sẵn có ảnh hưởng rõ rệt và đặc trưng đối với tính chất của vòng.
2. Danh pháp
a. Tên thường
Những hợp chất thơm, một số lớn gọi tên không theo danh pháp hệ thống mà thường dùng tên thông thường.
Một số tên thông thường của các hợp chất thơm
Ví dụ: toluen (metyl benzen); cumen (isopropyl benzen)...
b. Tên IUPAC
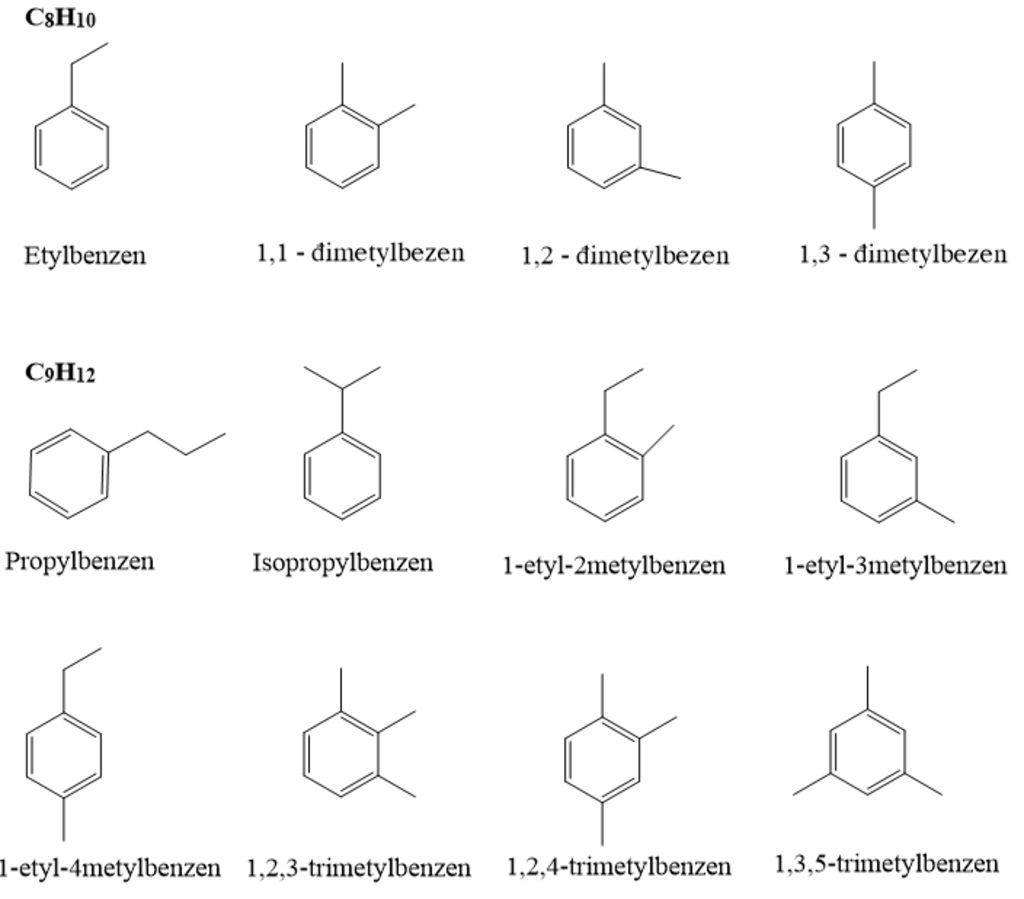
Chúng có tên chung là aren. Tuy nhiên các alkyl benzen, một số thường được xem là dẫn xuất aren nhưng một số khác thì thường gọi theo tên của ankan: phụ thuộc vào kích thước của nhóm thế alkyl
- Nếu alkyl có nhóm thế từ 6 hoặc ít hơn 6C, thì có tên: Alkyl benzen
- Nếu alkyl có nhóm thế lớn hơn 6C, thì có tên: phenyl alkan.
Khi gọi tên các đồng đẳng của benzen (Có nhánh) người ta dùng phương pháp đánh số để chỉ vị trí của các nhóm thế (nếu chỉ 1 nhóm thế thì nhóm thế đó coi như là C số 1), nếu có nhiều nhóm thế thì đánh số sao cho tổng chỉ số của nhóm thế là nhỏ nhất, khi gọi tên nhóm thế cũng theo thứ tự a,b,c...
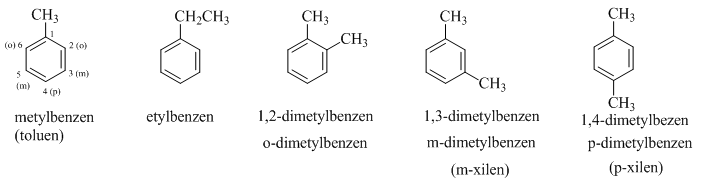
3. Lý tính
- Benzen và phần lớn các đồng đẳng benzen là chất lỏng, không màu, có mùi đặc biệt.
- Nhẹ hơn và không tan trong nước, tan trong dung môi hữu cơ.
- Nhiệt độ sôi của aren cao hơn alkan tương ứng. Nhiệt độ sôi của các đồng phân cũng rất khác nhau, đồng phân nhiều gốc hơn sôi ở nhiệt độ cao hơn đồng phân ít gốc hơn; đồng phân ortho sôi cao hơn đồng phân para....


.jpg)
.jpg)




.jpg)
.jpg)










