I - VỊ TRÍ NHÓM OXI TRONG BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ
Nhóm oxi bao gồm các nguyên tố oxi (O), lưu huỳnh (S), selen (Se), telu (Te) và poloni (Po) thuộc nhóm VIA của bảng tuần hoàn.
- Oxi là nguyên tố phổ biến nhất trên trái đất, chiếm khoảng 20% thể tích không khí, khoảng 50% khối lượng vỏ trái đất, khoảng 60% khối lượng cơ thể con người, 89% khối lượng nước.
- Lưu huỳnh có nhiều trong lòng đất. Ngoài ra lưu huỳnh có trong thành phần cảu dầu thô, khói núi lửa, cơ thể sống (dứoi dạng cầu nối kép −S−S− liên kết các chuối protein với nhau).
- Selen là chất bán dẫn rắn,màu nâu đỏ. Selen dẫn điện kém trong bóng tối, dẫn điện tốt khi được chiếu sáng.
- Telu là chất rắn, màu xám, thuộc loại nguyên tố hiếm.
- Poloni là nguyên tố kim loại, có tính phóng xạ.
II - CẤU TẠO NGUYÊN TỬ CỦA NHỮNG NGUYÊN TỐ TRONG NHÓM OXI
1.Giống nhau
Nguyên tử của các nguyên tố trong nhóm oxi có 6 electron ở lớp ngoài cùng: Obitan s có 2 electron và obitan p có 4 electron (ns2np4), trong đó có 2 electron độc thân:
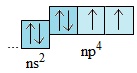
Khi tham gia phản ứng với những nguyên tố có độ âm điện nhỏ hơn, nguyên tử của những nguyên tố này có khả năng thu thêm 2 electron để có cấu hình electron bền vững (ns2np6). Các nguyên tố trong nhóm oxi có tính oxi hóa và có thể tạo nên những hợp chất, trong đó chúng có số oxi hóa −2.
2. Sự khác nhau giữa oxi và các nguyên tố trong nhóm
Nguyên tử nguyên tố O không có phân lớp d, Nguyên tử của những nguyên tố còn lại (S,Se,Te) có phân lớp d còn trống:
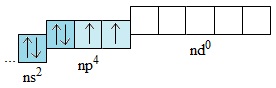
Những electron lớp ngoài cùng của các nguyên tử S,Se,Te khi được kích thích, chúng có thể chuyển đến những obitan d còn trống để tạo ra lớp ngoài cùng có 4 hoặc 6 electron độc thân:
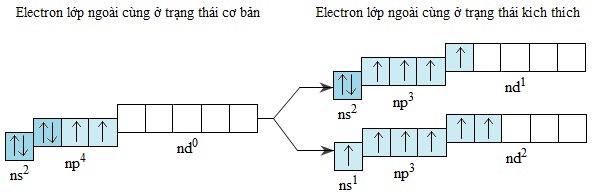
Do vậy khi tham gia phản ứng với những nguyên tố có độ âm điện lớn hơn, nguyên tử của các nguyên tố S,Se,Te có khả năng tạo nên những hợp chất có liên kết cộng hóa trị, trong đó chúng có số oxi hóa +4 hoặc +6.
III - TÍNH CHẤT CỦA CÁC NGUYÊN TỐ TRONG NHÓM OXI
1. Tính chất của đơn chất
Các nguyên tố trong nhóm oxi là những nguyên tố phi kim mạnh (trừ nguyên tố Po), chúng có tính oxi hóa mạnh (tuy nhiên yếu hơn so với những nguyên tố halogen ở cùng chu kì). Tính chất này giảm dần từ oxi đến telu.
2. Tính chất của hợp chất
- Hợp chất với hiđro (H2S,H2Se,H2Te) là những chất khí, có mùi khó chịu và độc hại. Dung dịch của chúng trong nước có tính axit yếu.
- Hợp chất hiđroxit (H2SO4,H2SeO4,H2TeO4) là những axit.
Bảng 6.1
Tóm tắt cấu tạo nguyên tử và tính chất của các nguyên tố trong nhóm oxi
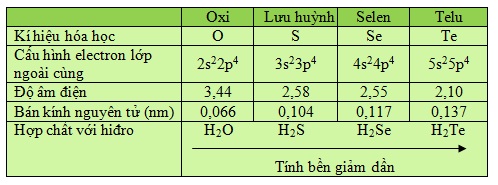

.jpg)
.jpg)




.jpg)
.jpg)










