I. ĐỒNG ĐẲNG, ĐỒNG PHÂN, DANH PHÁP
1. Dãy đồng đẳng ankin
Ankin: là những hidrocacbon mạch hở có 1 liên kết 3 (C≡C) trong phân tử.
Dãy đồng đẳng của ankin: C2H2, C3H4, … CnH2n-2 (n ≥2)
Công thức electron: 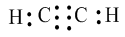
Công thức cấu tạo: H−C≡C−H
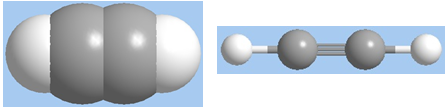
Mô hình phân tử axetilen dạng đặc và dạng rỗng
2. Đồng phân
Hai chất đầu dãy C2, C3 không có đồng phân ankin.
Các ankin từ C4 trở lên có đồng phân vị trí liên kết ba
Từ C5 còn có đồng phân mạch Cacbon (tương tự anken)
3. Danh pháp
a) Tên thông thường
.png)
b) Tên thay thế:
Số chỉ vị trí-tên nhánh|tên mạch chính|-số chỉ vị trí-in
Các ankin có liên kết ba đầu mạch (dạng R−C≡CH)
II. TÍNH CHẤT VẬT LÝ
Ankin có nhiệt độ sôi tăng dần theo chiều tăng của phân tử khối.
Ankin có nhiệt độ sôi cao hơn và khối lượng riêng lớn hơn các anken tương ứng.
Các ankin không tan trong nước và nhẹ hơn nước.
III. TÍNH CHẤT HÓA HỌC
Nguyên tử C của liên kết 3 ở trạng thái lai hoá sp (lai hoá phẳng) → (HCC) = 180o
Liên kết 3 C≡C gồm 1 liên kết σ và 2 liên kết π
1. Phản ứng cộng
a. Cộng Hidro
Dùng Pb/PdCO3 hoặc Pd/BaSO4. Ankin chỉ cộng một phân tử hidro tạo anken.
CH≡CH + H2 ![]() CH2 ═ CH2
CH2 ═ CH2
CH≡CH + 2H2 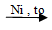 CH3 ─ CH3
CH3 ─ CH3
b. Cộng brom, clo
CH≡CH + Br2 → CHBr = CHBr
CHBr = CHBr + Br2 →CHBr2─CHBr2
c. Cộng nước (hiđrat hoá):
CH≡CH + H2O →(HgSO4, H2SO4)[CH2 = CH─OH]⥩CH3CHO
Lưu ý: Phản ứng cộng HX, H2O vào các ankin trong dãy đồng đẳng của axetilen cũng tuân theo quy tắc Maccopnhicop như anken.
d. Phản ứng đimehoá, trimehoá.
2 CH≡CH→(to, xt)CH2 ═ CH─C≡CH
3 CH≡CH→(to, xt)C6H6 (benzen)
1.3.2. Phản ứng thế bằng ion kim loại
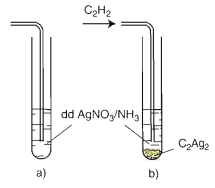
Phản ứng thế nguyên tử Hidro của C2H2 bằng ion bạc
a) trước khi sục khí C2H2 b) Sau khi sục khí C2H2
CH≡CH + 2AgNO3 + 2 NH3 → AgC≡CAg ↓vàng + 2 NH4NO3
Nguyên tử H đính với C mang liên kết 3 linh động hơn rất nhiều so với C liên kết đôi, đơn => nó có thế bởi ion KL.
Phản ứng này dùng để nhận biết các ankin 1 (có liên kết 3 ở đầu mạch)
RC≡CH + 2 AgNO3 + 2 NH3→ RC≡CAg + 2 NH4NO3
3. Phản ứng oxi hoá
a. Phản ứng oxi hoá hoàn toàn
2CnH2n-2 + (3n -1)O2 → 2nCO2 + 2(n-1) H2O
b. Phản ứng oxi hoá không hoàn toàn
Mất màu KMnO4
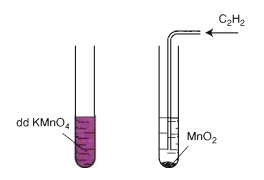
Axetilen làm mất màu dd thuốc tím
IV. ĐIỀU CHẾ
1. Phòng thí nghiệm
CaC2 + H2O → Ca(OH)2 + C2H2 ↑
2. Công nghiệp
Axetilen được sản xuất chủ yếu từ metan
2CH4 → C2H2 + 3H2 (ĐK: 1500oC)
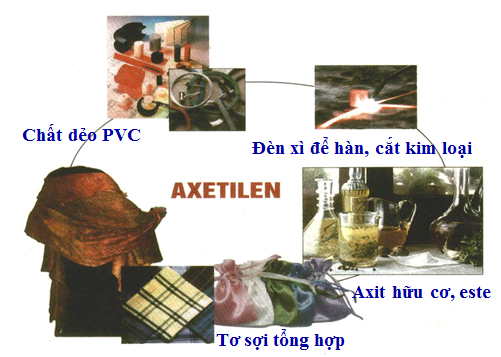
V. ỨNG DỤNG
Dùng trong công nghiệp hàn cắt kim loại
Nguyên liệu tổng hợp chất hữu cơ cơ bản.

.jpg)
.jpg)




.jpg)
.jpg)










