I- ĐỊNH NGHĨA, CẤU TẠO, DANH PHÁP
1. Định nghĩa
Amino axit là loại hợp chất hữu cơ tạp chức mà phân tử chứa đồng thời nhóm amino (NH2) và nhóm cacboxyl (COOH). Thí dụ:
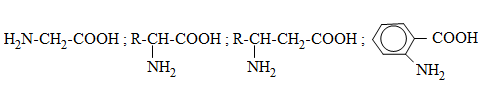
2. Cấu tạo phân tử
Vì nhóm COOH có tính axit, nhóm NH2 có tính bazơ nên ở trạng thái kết tinh amino axit tồn tại ở dạng ion lưỡng cực. trong dung dịch, dạng ion lưỡng cực chuyển một phần nhỏ thành dạng phân tử:

3. Danh pháp
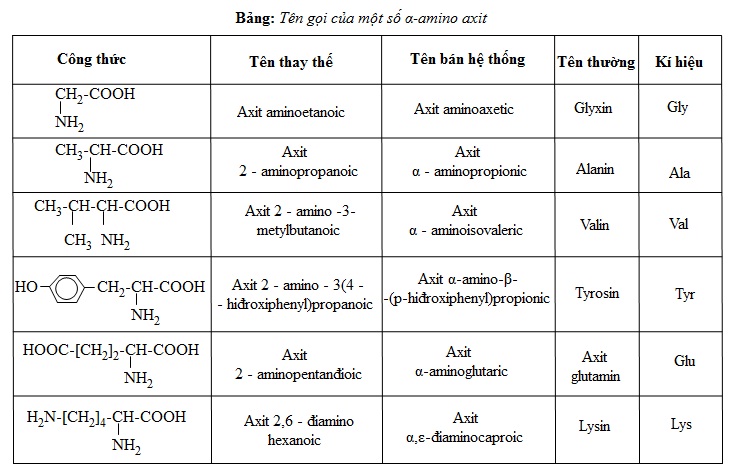
Có thể coi amino axit là axit cacboxylic có nhóm thế amino ở gốc hiđrocacbon. Do đó, tên gọi của các amino axit xuất phát từ tên của axit cacboxylic tương ứng (tên thay thế, tên thông thường), có thêm tiếp đầu ngữ amino và chữ số (2,3,...) hoặc chữ cái Hi Lạp (α,β,...) chỉ vị trí của nhóm NH2 trong mạch. Ngoài ra, các α -amino axit có trong thiên nhiên gọi là amino axit thiên nhiên đều có tên riêng (như bảng dưới) và hầu hết có công thức chung là:
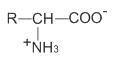 nhưng vẫn gọi tên theo dạng:
nhưng vẫn gọi tên theo dạng: 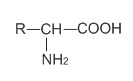 (R là phần còn lại của phân tử).
(R là phần còn lại của phân tử).
II- TÍNH CHẤT VẬT LÍ
Các amino axit là những chất rắn ở dạng tinh thể không màu, vị hơi ngọt, có nhiệt độ nóng chảy cao (khoảng từ 220 đến 300oC, đồng thời bị phân hủy) và dễ tan trong nước vì chúng tồn tại ở dạng ion lưỡng cực (muối nội phân tử). Thí dụ: Glyxin nóng chảy ở khoảng 232−236oC, có độ tan 25,5g/100g nước ở 25oC
III- TÍNH CHẤT HÓA HỌC
1. Tính chất axit-bazơ của dung dịch amino axit
Thí nghiệm: Nhúng quỳ tím vào các dung dịch glyxin (ống nghiệm 1) vào dung dịch axit glutamic (ống nghiệm 2) và vào dung dịch lysin (ống nghiệm 3)
Hiện tượng: Trong ống nghiệm (1) màu quỳ tím không đổi. Trong ống nghiệm (2) quỳ tím chuyển thành màu hồng. Trong ống nghiệm (3) quỳ tím chuyển thành màu xanh.
Giải thích: Phân tử glyxin có một nhóm COOH và một nhóm NH2 nên dung dịch gần như trung tính.
Phân tử axit glutamic có hai nhóm COOH và một nhóm NH2 nên dung dịch có môi trường axit.
Phân tử lysin có hai nhóm NH2 và một nhóm COOH nên dung dịch có môi trường bazơ.
Amino axit phản ứng với axit vô cơ mạnh cho muối, thí dụ:
H2N−CH2−COOH+HCl→CH3NCH2COOH
hoặc
H3N+−CH2−COO−+HCl→ClH3NCH2COOH
Amino axit phản ứng với bazơ mạnh cho muối và nước, thí dụ:
H2N−CH2−COOH+NaOH→H2N−CH2−COONa+H2O
hoặc
H3N+−CH2−COO−+NaOH→H2N−CH2−COONa+H2O
Như vậy, amino axit có tính chất lưỡng tính.
2. Phản ứng este hóa nhóm COOH
Tương tự axit cacboxylic, amino axit phản ứng được với ancol (có axit vô cơ mạng xúc tác) cho este. Thí dụ:
H2NCH2COOH+C2H5OH⇆ (khíHCl) H2NCH2COOC2H5+H2O
3. Phản ứng của nhóm NH2 với HNO2
Thí nghiệm: Cho vào ống nghiệm 2ml dung dịch glyxin 10%, 2ml dung dịch NaNO210% và 5−10 giọt axit axetic. Lắc nhẹ ống nghiệm và quan sát.
Hiện tượng: Có bọt khí bay lên.
Giải thích: HNO2 (tạo thành từ NaNO2+CH3COOH) phản ứng với nhóm NH2 của glyxin (tương tự amin) cho axit hiđroxiaxetic và giải phóng N2:
H2NCH2COOH+HNO2→HOCH2COOH+N2↑+H2O
4. Phản ứng trùng ngưng
Khi đun nóng axit 6-aminohexanoic (còn gọi là axit ε-aminocaproic) hoặc axit 7-aminoheptanoic (axit ω-aminoenantoic) với xúc tác thì xảy ra phản ứng trùng ngưng tạo thành polime thuộc loại poliamit.
Trong phản ứng trùng ngưng amino axit, OH của nhóm COOH ở phân tử amino axit này kết hợp với H của nhóm NH2 ở phân tử amino axit kia tạo thành H2O và sinh ra polime do các gốc amino axit kết hợp với nhau, thí dụ:
.png)
IV- ỨNG DỤNG
- Amino axit thiên nhiên (hầu hết là α -amino axit) là cơ sở để kiến tạo nên các loại protein của cơ thể sống.
- Một số amino axit được dùng phổ biến trong đời sống như muối mononatri của axit glutamic dùng làm gia vị thức ăn (gọi là mì chính hay bột ngọt); axit glutamic là thuốc hỗ trợ thần kinh, methionin là thuốc bổ gan.
- Axit 6-aminohexanoic và axit 7-aminoheptanoic là nguyên liệu để sản xuất tơ nilon-6 và nilon-7.

.jpg)
.jpg)




.jpg)
.jpg)










